Ein Blick auf die aktuelle Situation rund um CBD und Novel Food mit einer Einschätzung von Apotheker Prof. Dr. Markus Veit.
Anfang Juni gab die Lebensmittelbehörde der Europäischen Kommission (EFSA) bekannt, dass die Bewertung der eingereichten Novel Food Anträge zu Cannabinoiden nicht weiter bearbeitet werden können. Daher werden die Bewertungen zu Cannabidiol als neuartiges Lebensmittel bis zum Vorliegen neuer Daten ausgesetzt. Die EFSA betont in der Pressemitteilung, dass die “Sicherheit von Cannabidiol (CBD) als neuartiges Lebensmittel aufgrund von Datenlücken und Unsicherheiten” in Bezug auf das Risiko von CBD aktuell “nicht feststellbar sei”.
Hinzufügen des Eintrags zu Cannabinoiden
Seit der Klarstellung seitens der Europäischen Kommission und dem Hinzufügen des Eintrags zu Cannabinoiden ist klar, dass Einzelcannabinoide, aber auch verschiedene andere Cannabinoid-Zutaten unter die Novel Food Verordnung fallen. Nun haben die Wissenschaftler der EFSA festgestellt, dass die Sicherheit von Cannabidiol (CBD) nicht bewertet werden kann. Cannabidiol kann sowohl natürlich vorkommen, als auch synthetisch hergestellt werden. Es ist auch Bestandteil der Anträge, die aktuell bereits im Antragsregister der Europäischen Kommission vorliegen. Für Cannabidiol gab es schon vor dem Hinzufügen des Eintrags Anträge z.B. vom Hersteller CBDepot in Tschechien.

https://webgate.ec.europa.eu/fip/novel_food_catalogue/ – Eintrag Cannabinoide im Novel Food Katalog
CBD und Novel Food – Stellungsnahme der EFSA
Die Europäische Kommission geht davon aus, dass CBD als neuartiges Lebensmittel eingestuft werden kann, sofern es die Bedingungen der EU-Rechtsvorschriften über neuartige Lebensmittel erfüllt. Nachdem im Rahmen der Verordnung über neuartige Lebensmittel zahlreiche Anträge für CBD eingereicht worden waren, ersuchte die Kommission die EFSA um eine Stellungnahme zu der Frage, ob der Verzehr von CBD für den Menschen unbedenklich ist.
Anträge entsprechen nicht den Anforderungen
Das Sachverständigengremium der EFSA für Ernährung, neuartige Lebensmittel und Lebensmittelallergene (NDA-Gremium) hat 19 Anträge auf Zulassung von CBD als neuartiges Lebensmittel erhalten, wobei noch weitere in Vorbereitung sind. Bereits davor war bekannt geworden, dass ‘viele’ der über 50 Anträge, die bisher für die Zulassung als Novel Food eingegangen seien, nicht von ausreichender Qualität sind, oder nicht genügend Informationen enthielten, um validiert oder zur technischen Bewertung an die [Europäische Behörde für Lebensmittelsicherheit] EFSA weitergeleitet zu werden”. krautinvest.de berichtete.
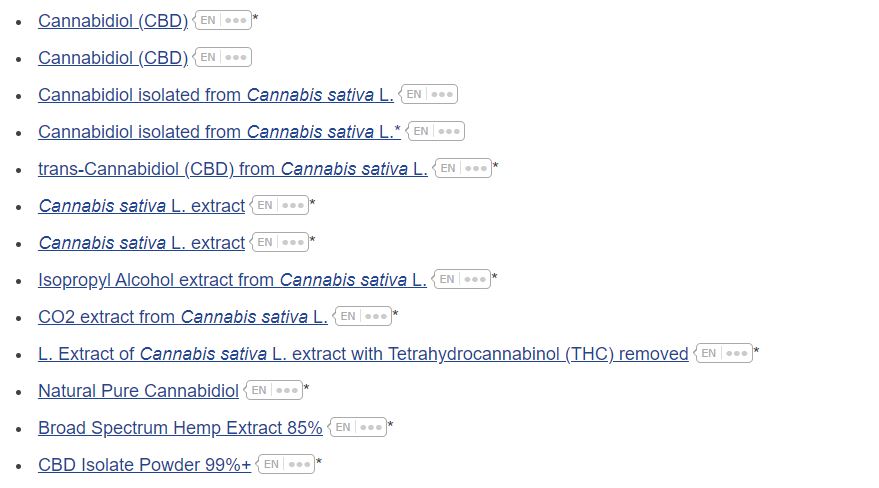
Auszug eingereichter Novel Food Anträge zu Cannabinoiden (nicht abschließend)
Übersicht: aktuell einsehbare Anträge
Alle erhaltenen Anträge sind im Antragsregister einsehbar. Wir haben uns die Arbeit gemacht und haben für Euch die Anträge nachfolgend aufgelistet (Stand: Juli 2022). Details findet man auf Englisch in der jeweiligen Antragsübersicht der Einzelanträge im Register für die, die es näher interessiert.
| Antragsgegenstand | Antragsteller |
| Broad Spectrum Hemp Extract 85% | SPECTRUMS EUROPE, Paris (France) |
| Cannabidiol (CBD) | BSPG Laboratories Ltd., Kent (Ireland) |
| Cannabidiol (CBD) | Pharmahemp d.o.o., Ljubljana (Slovenia) |
| Cannabidiol isolated from Cannabis sativa L. | HEMPOLAND spółka z ograniczoną odpowiedzialnością, Elbląg (Poland) |
| Cannabidiol isolate from Cannabis sativa L. | CBD Industries LLC North Carolina (United States of America) |
| trans-Cannabidiol (CBD) from Cannabis sativa L. | CBDepot s.r.o., Masarykova (Czech Republic) |
| Cannabis sativa L. extract | Pharmahemp d.o.o., Ljubljana (Slovenia) |
| Cannabis sativa L. extract | Linnea SA, Riazzino (Switzerland) |
| Isopropyl Alcohol (IPA) extract from Cannabis sativa L. | Charlotte’s Web Inc., Boulder (United States of America) |
| CO2 extract from Cannabis sativa L. | Charlotte’s Web Inc., Boulder (United States of America) |
| Extract of Cannabis sativa L. extract with Tetrahydrocannabinol (THC) removed | Charlotte’s Web Inc., Boulder (United States of America) |
| Natural Pure Cannabidiol | Linnea SA, Riazzino (Switzerland) |
| Broad Spectrum Hemp Extract 85% (2) | SPECTRUMS EUROPE, Paris (France) |
| CBD Isolate Powder 99%+ | SPECTRUMS EUROPE, Paris (France) |
| Refined industrial hemp extract from Cannabis sativa L. | Dun Agro Plant Products B.V., JE Oude Pekela (the Netherlands) |
| Synthetic Cannabidiol (CBD) | PureForm Global Inc. and PureForm International Ltd. Wiltshire (United Kingdom) |
| Synthetic trans-Cannabidiol | CBDepot s.r.o., Masarykova (Czech Republic) |
| (-)-Cannabidiol derived from chemical synthesis | Cibdol AG, Liestal (Switzerland) |
| Cannabidiol | Chanelle McCoy CBD LTD, Galway (Ireland) |
| Synthetic Cannabidiol (CBD) | Farmabios S.p.A. Gropello Cairoli (Italy) |
Cannabinoid-Anträge können weiterhin eingereicht werden
Es ist spannend zu sehen, dass mehrere Hersteller gleich mehrere Anträge eingereicht haben. Ebenso sind aktuell keine Anträge aus Deutschland zu finden, obwohl sich hier einer größten Europäischen Märkte befindet. Auch der Sammelantrag der EIHA für verschiedene Zutaten ist noch nicht eingereicht, wobei die EIHA auf Linkedin angab, dass man den Anforderungen gewachsen sei. Nur weil die Risikobewertung ausgesetzt ist, heißt es nicht, dass auch weitere Anträge bearbeitet werden können. In Deutschland ist die zuständige Behörde das BVL, an das man entsprechend seinen Antrag richten kann (nähere Informationen gibt es hier)
Sicher oder nicht sicher – Die Entscheidung zu CBD steht aus
Der Vorsitzende des NDA-Gremiums, Prof. Dominique Turck, erklärte dazu in einer Meldung: „Wir haben eine Reihe von Gefahren im Zusammenhang mit der Aufnahme von CBD ermittelt und festgestellt, dass die zahlreichen Datenlücken zu diesen gesundheitlichen Auswirkungen geschlossen werden müssen, bevor diese Bewertungen weitergeführt werden können. An dieser Stelle ist zu betonen, dass wir nicht zu dem Schluss gekommen sind, dass CBD als Lebensmittel nicht sicher ist.“
EFSA-Informationsveranstaltung zur Sicherheit von Cannabidiol
Am 28. Juni organisierte die EFSA eine Informationsveranstaltung, um den Interessengruppen die kürzlich veröffentlichte EFSA-Erklärung zur Sicherheit von Cannabidiol (CBD) als neuartiges Lebensmittel und die dabei identifizierten Datenlücken und Unsicherheiten zu erläutern. Eine ausführliche Darstellung der Thematik findet sich auch in einer diesbezüglichen Publikation der EFSA. Die Datenlücken betreffen die ADME (Absorption, Distribution, Metabolismus und Elimination) Charakteristika von CBD, das Interaktionspotential mit Arzneimitteln sowie dessen Sicherheit bei der Einnahme von CBD als Lebensmittel oder Nahrungsergänzungsmittel. Der Phyto-Experte Prof. Dr. Markus Veit von Alphatopics hat die Informationsveranstaltung besucht und für uns nachfolgend die wichtigsten Punkte zusammengefasst.

Der Apotheker und Phytoexperte Prof. Dr. Markus Veit war bei der Informationsveranstaltung anwesend und berichtet uns das Erlebte.
Das wurde auf der Veranstaltung gesagt (zusammengefasst von Prof. Dr. Markus Veit):
Die Wirkung von CBD auf die Leber, den Magen-Darm-Trakt, das endokrine System, das Nervensystem, die Psyche muss noch geklärt werden. Studien an Tieren zeigen eine signifikante Reproduktionstoxizität; inwieweit diese beim Menschen im Allgemeinen und bei Frauen im gebärfähigen Alter im Besonderen auftritt, muss noch untersucht werden. Solange die Antragsteller keine Daten vorlegen, die geeignet sind, diese Lücken zu schließen wird die EFSA die vorliegenden Anträge für CBD-haltige neuartige Lebensmittel nicht weiterbearbeiten. Folgende Aspekte sind dabei von zentraler Bedeutung:
- Vorliegende Daten wurden häufig mit Zubereitungen etabliert, die nicht ausreichend charakterisiert waren, bzw. es fehlen Daten für eine bestimmte Zubereitung. Es wird häufig übersehen, dass die systemische Exposition von CBD nicht nur von der aufgenommen Menge CBD, sondern auch von der Zubereitung (der Matrix), der Art der Aufnahme (als Nahrungsergänzungsmittel oder in einer lebensmittelnahen Zubereitung) abhängig ist. ADME-Daten und Sicherheitsdaten sind daher immer spezifisch für eine bestimmte Zubereitung und nicht immer auf andere Zubereitungen übertragbar.
- Publizierte Sicherheitsdaten für Arzneimittel (also bspw. für Epidyolex) sind, wenn nur bedingt geeignet, die Sicherheit von CBD-haltigen Lebensmitteln und Nahrungsergänzungsmittel zu beurteilen. Das gilt daher, weil sie in der Regel mit höheren Dosen, mit anderen Zubereitungen und mit Patienten (ggf. unter Komedikation) und nicht mit einem repräsentativen Kollektiv gesunder Menschen erhalten wurden. Außerdem sind die Expositionszeiträume andere.
- Von zentraler Bedeutung bei der Bewertung der Sicherheit von Lebensmittel ist der “No Observed Adverse Effect Level – NOAEL”, die höchste Konzentration oder Menge eines Stoffs, bei der in einer exponierten Population keine nachweisbare nachteilige Wirkung auftritt und auch der “Lowest Observed Adverse Effect Level – LOAEL ist die niedrigste Dosis eines Stoffs, bei der in einer exponierten Population nachteilige Wirkungen zu erwarten sind. Jeweils für eine bestimmte organspezifische Toxizität, Auswirkungen auf endokrine Funktionen, Funktionen und Organe des Reproduktionssystems oder das Interaktionspotential. Insbesondere zum Beleg eines LOAEL fehlen die Daten, da tierexperimentelle und humane Studien mit niedrigen Dosen fehlen. Auf welcher Datenbasis diese Expositionsgrenzen zu ermitteln sind, wird in der ” Guidance on the preparation and submission of an application for authorisation of a novel food in the context of Regulation (EU) 2015/2283” dargelegt, die offensichtlich von den bisherigen Antragstellern unisono nicht ausreichend beachtet wurde.
CBD-Firmen müssen ihre Hausaufgaben machen
Die vorgelegten Daten sind aus Sicht der EFSA (bisher) nicht geeignet die sichere bzw. nicht schädliche Exposition von CBD zu belegen. Zwischen den Zeilen war den Ausführungen der EFSA-Assessoren zu entnehmen, dass nur wenige Studien vorliegen bzw. eingereicht wurden, die lebensmittelspezifisch sind hinsichtlich der untersuchten Dosen und der Targetpopulationen, also häufig Daten verwendet wurden, die aus dem Arzneimittelsektor stammen. Man kann daher der agierenden Industrie nur raten, die notwenigen Hausaufgaben nun sachgerecht anzugehen.
Auswirkungen auf andere Bereiche wahrscheinlich
Die Bewertung der EFSA hat auch Auswirkungen auf CBD-Produkte, die als Kosmetika vermarktet werden, weil man Zweifel haben muss, ob deren Sicherheit ausreichend belegt ist. Das gilt insbesondere auch deshalb, weil die transdermale Bioverfügbarkeit von CBD besser ist als die orale und auch für Kosmetika eine systemische Exposition relevant sein kann und auch Zweifel bestehen, ob die erforderlichen Daten für die lokale Verträglichkeit vorliegen. Das gilt in Analogie für Produkte zum Rauchen oder zur Verdampfung.
Über Prof. Dr. Markus Veit:
Markus Veit promovierte 1990 an der Julius-Maximilians-Universität Würzburg, Deutschland. Im Jahr 1998 erhielt er den Egon-Stahl-Price-Preis der Internationalen Gesellschaft für Arzneipflanzenforschung. Seine akademischen Forschungsinteressen umfassten bioanalytische Methoden für Wirkstoffe in pflanzlichen Arzneimitteln, die Qualität pflanzlicher Arzneimittel, Pharmakokinetik und Bioverfügbarkeit von Pflanzenphenolen, Pharmakodynamik von Pflanzenphenolen und die Wirksamkeit pflanzlicher Arzneimittel. Dr. Veit veröffentlichte mehr als 50 begutachtete Publikationen. 1999 verließ Dr. Veit seine volle Stelle an der Universität Würzburg und begann eine Karriere außerhalb der akademischen Welt, lehrt aber immer noch an der Fakultät für Pharmazie der Universität Frankfurt und an der Humboldt-Universität zu Berlin. Dr. Veit war Geschäftsführer von Unternehmen, die regulatorische und analytische Dienstleistungen für die pharmazeutische Industrie anbieten. 2011 gründete er Alphatopics, ein Unternehmen, das Trainings- und Beratungsdienstleistungen anbietet. Er ist Mitglied des Fachausschusses Pharmazeutische Chemie des Deutschen Arzneibuches. Seit 1997 hat Dr. Veit mehr als 300 Symposien und Seminare zu seinen Hauptinteressen und Fachgebieten organisiert, geleitet und mitgestaltet: Arzneimittelzulassung, Qualität von Arzneimitteln und Medizinprodukten, pharmazeutische Entwicklung, Entwicklung und Validierung bioanalytischer Methoden.

